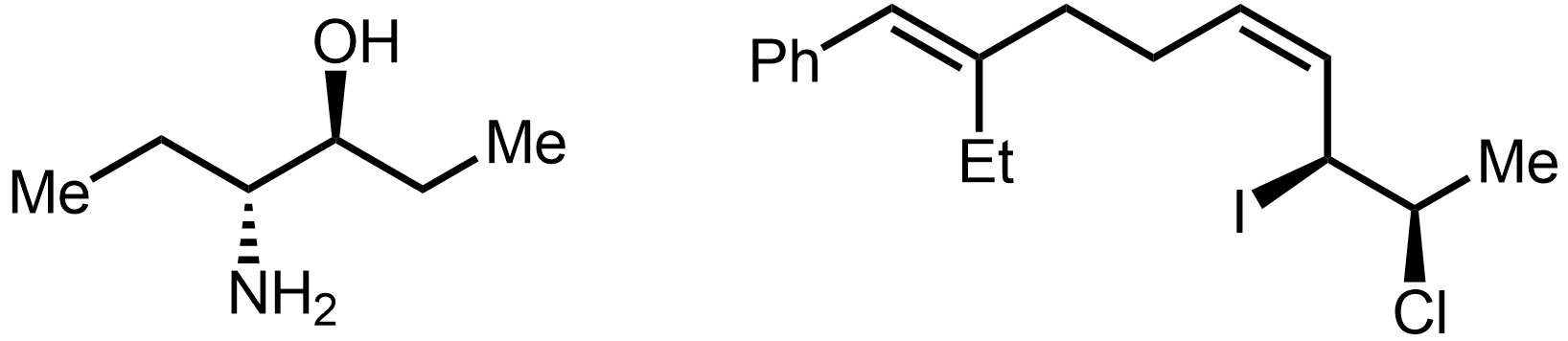
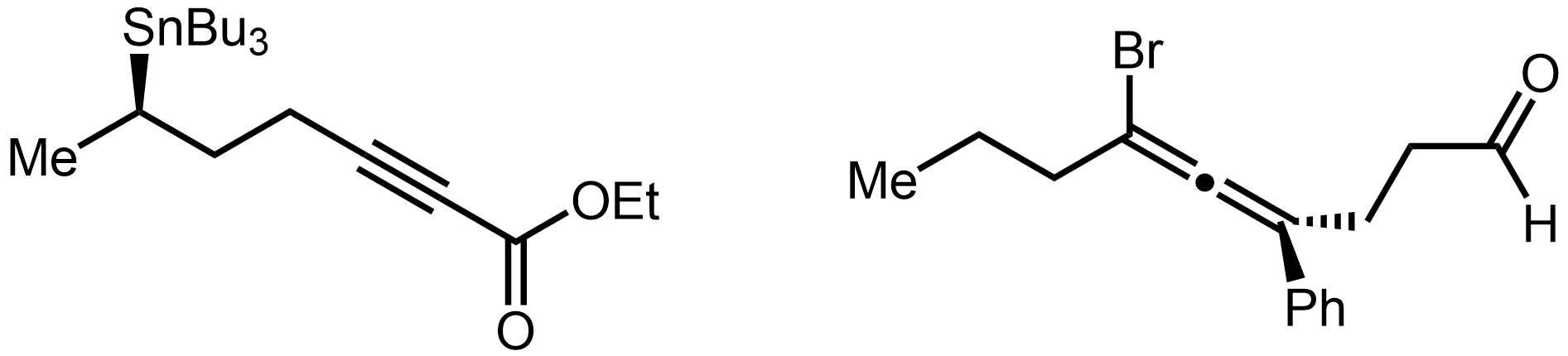
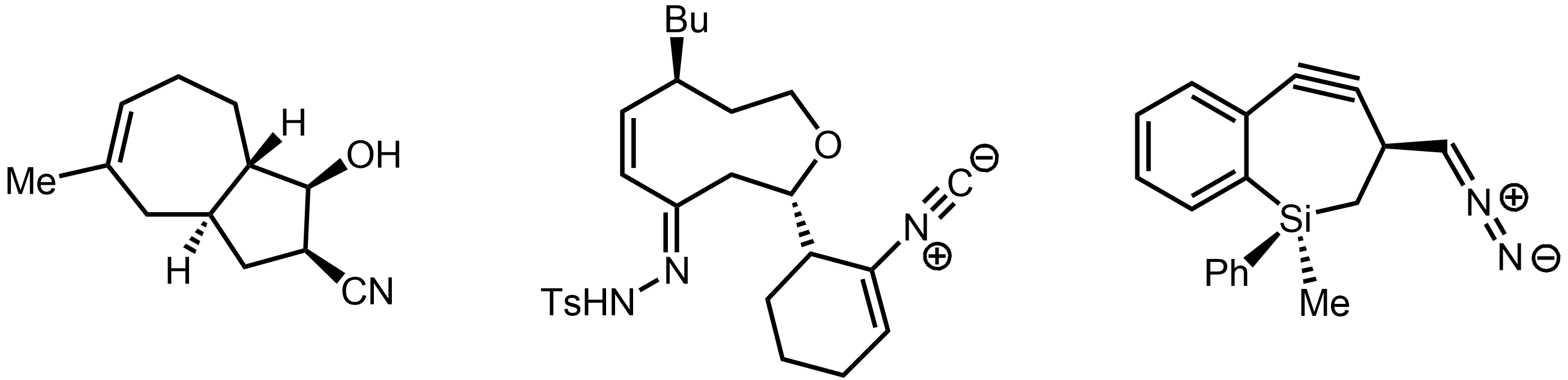
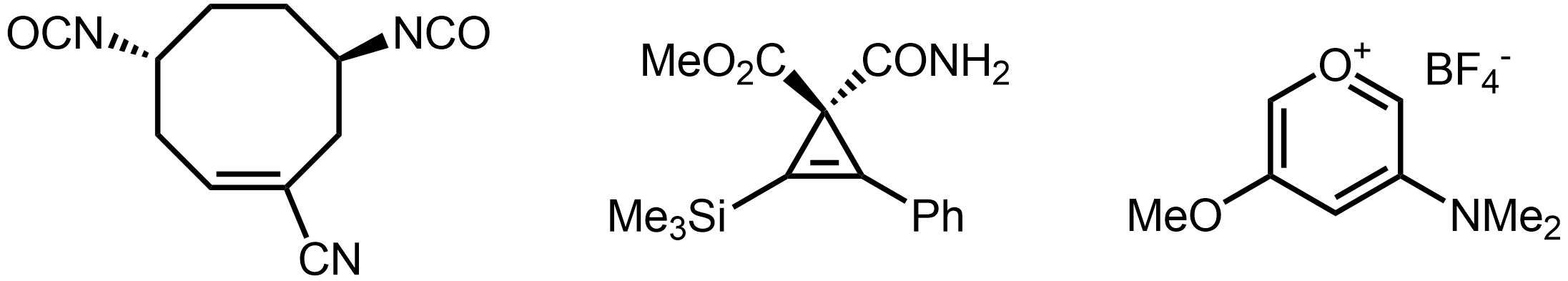
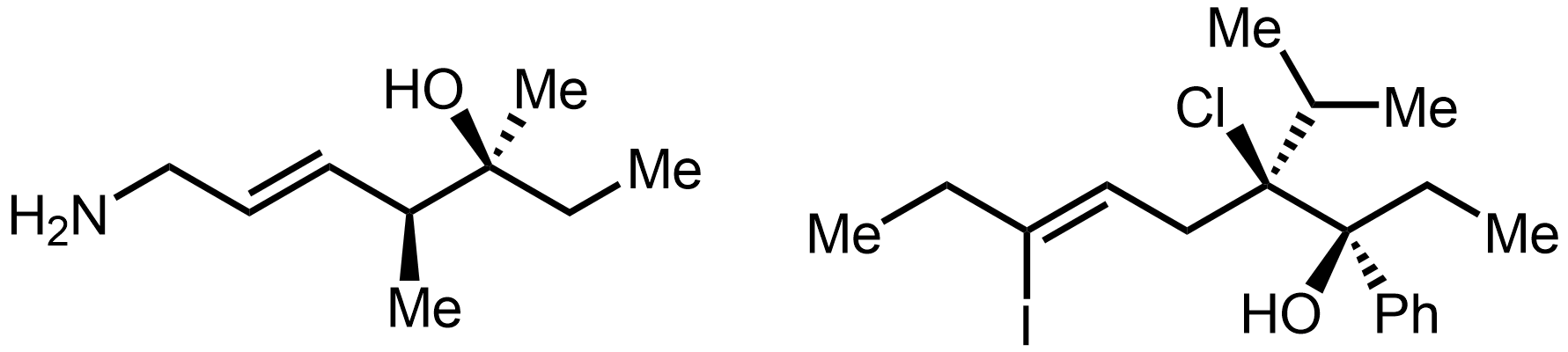골격 구조식
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
골격 구조식은 유기 화합물의 구조를 나타내는 데 사용되는 간결한 표현 방식이다. 이 구조식은 탄소 골격을 선으로 표현하고, 탄소와 결합된 수소는 생략하며, 탄소가 아닌 다른 원자(헤테로원자)는 기호로 명시한다. 이중 결합과 삼중 결합은 각각 두 개와 세 개의 선으로 표시하며, 입체화학 정보는 쐐기형 선과 파선으로 나타낸다. 1980년대에 현대적인 표기 규칙이 정립되었으며, 벤젠 고리는 단일 결합과 이중 결합이 교대로 나타나는 육각형 또는 원을 포함하는 형태로 표현된다.
더 읽어볼만한 페이지
- 화학 구조 - 구조식
구조식은 분자를 이루는 원자들의 연결 방식과 결합 형태를 시각적으로 나타내는 화학식으로, 루이스 구조식, 간략 구조식, 골격 구조식 등 다양한 표현 방식이 있다. - 화학식 - 실험식
실험식은 화합물을 구성하는 원소의 원자 수 비율을 가장 간단한 정수비로 나타낸 것으로, 분자식과는 달리 이성질체나 분자 구조는 알 수 없지만 원소 분석을 통해 얻을 수 있으며, 물리학에서는 실험적 관계에서 유래한 수학 방정식을 의미한다. - 화학식 - 구조식
구조식은 분자를 이루는 원자들의 연결 방식과 결합 형태를 시각적으로 나타내는 화학식으로, 루이스 구조식, 간략 구조식, 골격 구조식 등 다양한 표현 방식이 있다. - 유기화학 - 유기 화합물
유기 화합물은 탄소를 포함하는 화합물로, 과거 생기론으로 여겨졌으나 뵐러의 요소 합성으로 폐기되었고, 이후 다양한 유기 화합물 합성 및 고분자 개발에 기여했지만 환경 친화적 접근이 과제로 남아 있으며, 구조, 용도 등으로 분류되고 천연물, 합성 화합물 등으로 연구된다. - 유기화학 - 유기물
유기물은 생물체 구성 성분으로서 생태계 내에서 영양분 순환, 토양의 물리화학적 성질 개선, pH 조절 등 중요한 역할을 수행하며, 탄소, 산소, 수소, 질소 등으로 구성된 유기 화합물의 혼합물이다.
2. 골격 구조식
루이스 구조식처럼 공유 결합은 선분으로 표시되며, 이중 결합 또는 삼중 결합은 각각 이중 또는 삼중 선분으로 나타낸다. 골격 구조식은 각 원자에 관련된 형식 전하를 나타내지만, 고립 전자쌍은 보통 생략한다. 골격 구조식은 다음과 같은 단순화된 루이스 구조식으로 볼 수 있다.
- 탄소 원자는 선분의 꼭짓점(교차점 또는 끝점)으로 표시된다. 명확성을 위해 메틸기는 Me 또는 CH3로, (헤테로)큐뮬렌 탄소는 굵은 중간점으로 나타내기도 한다.
- 탄소에 붙은 수소 원자는 생략한다. 레이블이 없는 꼭짓점은 옥텟 규칙을 만족하는 데 필요한 수소 수만큼 탄소가 결합된 것으로 이해한다. 형식 전하나 비결합 전자가 표시된 꼭짓점은 해당 특성을 부여하는 데 필요한 수소 원자 수를 갖는 것으로 이해한다. 아세틸렌 및 포름일 수소는 명확성을 위해 명시적으로 표시할 수 있다.
- 헤테로원자에 붙은 수소 원자는 명시적으로 표시한다. 헤테로원자와 수소 원자는 보통 수소-헤테로원자 결합을 표시하지 않고 OH, NH2와 같이 하나의 그룹으로 나타낸다. 메톡시기(OMe)나 디메틸아미노(NMe2)처럼 단순한 알킬 또는 아릴 치환기를 갖는 헤테로원자도 비슷하게 표시한다.
- 카벤 탄소의 고립 전자쌍은 반드시 표시해야 하며, 다른 경우의 고립 전자쌍은 선택 사항이다. 주족 원소의 형식 전하와 짝을 이루지 않은 전자는 항상 명시적으로 표시한다.
분자의 표준 묘사에서는 가장 크게 기여하는 정규형(공명 구조)을 그린다. 그러나 골격 구조식은 모든 기여하는 정규형의 가중 평균인 "실제 분자"를 나타내는 것으로 이해한다. 벤젠이나 카복실산 음이온처럼 두 개 이상의 정규형이 동일한 가중치로 기여하는 경우, 임의로 하나의 정규형을 선택하여 그리더라도, 골격 구조식은 비편재화된 결합이 비동등한 단일 및 이중 결합으로 묘사되더라도 분수 차수의 동등한 결합을 포함하는 실제 구조를 나타내는 것으로 이해한다.[2]
1980년대 ChemDraw 소프트웨어 패키지가 사실상 업계 표준으로 채택되면서 정립된 현대 골격 구조식의 그래픽 규칙은 1990년대 후반부터 화학 문헌에서 거의 보편적으로 사용되고 있다.[3] 대부분의 저자들이 따르는 규칙은 다음과 같다.
탄소나 수소가 아닌 모든 원자는 화학 기호로 표시한다. 예를 들어 염소는 Cl, 산소는 O, 나트륨은 Na 등이다. 유기 화학에서 이러한 원자는 보통 '''헤테로원자'''라고 한다. (''헤테로-''는 "다른"을 의미하는 그리스어 ''ἕτερος'' héteros에서 유래.)[4]
헤테로원자에 결합된 수소 원자는 ''명시적으로'' 그린다. 에탄올(C2H5OH)에서 산소에 결합된 수소 원자는 H로 표시하지만, 탄소에 결합된 수소는 직접 표시하지 않는다. 헤테로원자-수소 결합을 나타내는 선은 보통 생략하므로 하이드록시기는 −O−H 대신 −OH로 쓴다. 반응 메커니즘에 참여할 때는 존재를 강조하기 위해 이러한 결합을 전부 그리기도 한다.
골격 구조식에서는 화학 기호처럼 보이지만, 특정 흔한 치환체나 원소 그룹의 지정되지 않은 구성원을 나타내는 기호도 있다. 이를 의사 원소 기호 또는 유기 원소라고 하며, 골격 구조식에서 1가 "원소"처럼 취급한다.[4]
일반적인 의사 원소 기호, 유기 원소 기호, 방향족 및 불포화 치환기, 작용기, 설포닐/설폰산염 그룹, 보호기는 다음과 같다.
두 원자는 여러 쌍의 전자를 공유하여 결합할 수 있다. 탄소의 일반적인 결합은 단일 결합, 이중 결합, 삼중 결합이다. 단일 결합은 골격 구조식에서 두 원자 사이의 실선 하나로 표시한다. 이중 결합은 평행선 두 개, 삼중 결합은 평행선 세 개로 표시한다.
고급 결합 이론에서는 결합 차수가 정수가 아닌 경우도 있다. 이때 실선과 점선의 조합은 각각 결합 차수의 정수 부분과 비정수 부분을 나타낸다.
방향족 벤젠 고리는 두 가지 방식으로 표현할 수 있다.
- 케쿨레 스타일: 1872년 케쿨레가 제안한 방식으로, 단일 결합과 이중 결합이 번갈아 나타나는 육각형이다. 벤젠의 두 정준 형태는 모든 탄소-탄소 결합 길이가 같고 결합 차수가 1.5임을 나타낸다.
- 틸레 스타일: 틸레가 제안한 방식으로, 비편재화된 파이 오비탈을 육각형 내부에 원을 그려 표현한다. 과거 유기 화학 입문 교과서에서 흔히 사용되었으며, 비공식적으로 종종 사용된다.

최근에는 전자의 움직임을 정확하게 표현하고 전자쌍을 추적할 수 있는 케쿨레 스타일이 교육 및 학술적으로 주로 사용된다.
2. 1. 명명법
유기 화합물의 골격 구조는 화합물의 본질적인 구조를 형성하는 일련의 결합된 원자이다. 골격은 결합된 원자의 사슬, 가지 및/또는 고리로 구성될 수 있다. 탄소나 수소가 아닌 골격 원자는 헤테로원자라고 한다.[2]골격에는 수소 및/또는 다양한 치환기가 원자에 결합되어 있다. 수소는 탄소에 결합된 가장 흔한 비탄소 원자이며, 간단하게 나타내기 위해 명시적으로 그려지지 않는다. 또한, 탄소 원자는 일반적으로 직접적으로 ("C"로) 표시되지 않지만, 헤테로원자는 항상 명시적으로 표시된다("N"은 질소, "O"는 산소 등).
화합물에 기능을 부여하는 헤테로원자 및 기타 원자 그룹은 작용기라고 한다. 작용기는 비교적 높은 화학 반응 속도를 발생시키거나 화합물의 스펙트럼에 특정하고 흥미로운 특성을 도입한다. 헤테로원자와 작용기는 유기 화합물의 모체 탄화수소에 존재할 수소 원자를 대체하는 것으로 간주되므로 통칭하여 "치환기"라고 한다.
2. 2. 기본 구조 표현
루이스 구조식과 마찬가지로, 공유 결합은 선분으로 표시되며, 이중 결합 또는 삼중 결합은 각각 이중 또는 삼중 선분으로 표시된다. 골격 구조식은 각 원자에 관련된 형식 전하를 나타낸다(단, 고립 전자쌍은 일반적으로 선택 사항임). 골격 구조식은 다음과 같은 단순화를 준수하는 축약된 루이스 구조식으로 생각할 수 있다.- 탄소 원자는 선분의 꼭짓점(교차점 또는 종점)으로 표시된다. 명확성을 위해 메틸기는 종종 Me 또는 CH3로 명시적으로 표기하며, (헤테로)큐뮬렌 탄소는 종종 굵은 중간점으로 표시된다.
- 탄소에 부착된 수소 원자는 생략된다. 레이블이 없는 꼭짓점은 옥텟 규칙을 충족하는 데 필요한 수소 수에 부착된 탄소를 나타내는 것으로 이해되며, 형식 전하 및/또는 비결합 전자(들)로 레이블이 지정된 꼭짓점은 탄소 원자에 이러한 표시된 특성을 부여하는 데 필요한 수소 원자 수를 갖는 것으로 이해된다. 선택적으로, 아세틸렌 및 포름일 수소는 명확성을 위해 명시적으로 표시될 수 있다.
- 헤테로원자에 부착된 수소 원자는 명시적으로 표시된다. 헤테로원자와 이에 부착된 수소 원자는 일반적으로 수소-헤테로원자 결합을 명시적으로 표시하지 않고 단일 그룹(예: OH, NH2)으로 표시된다. 메톡시(OMe) 또는 디메틸아미노(NMe2)와 같이 단순한 알킬 또는 아릴 치환기를 갖는 헤테로원자는 유사하게 표시되는 경우가 있다.
- 카벤 탄소의 고립 전자쌍은 명시적으로 표시해야 하며, 다른 경우의 고립 전자쌍은 선택 사항이며 강조를 위해 표시된다. 반대로, 주족 원소의 형식 전하 및 짝을 이루지 않은 전자는 항상 명시적으로 표시된다.
분자의 표준 묘사에서, 가장 큰 기여를 하는 정규형 (공명 구조)이 그려진다. 그러나 골격 구조식은 모든 기여하는 정규형의 가중 평균인 "실제 분자"를 나타내는 것으로 이해된다. 따라서 두 개 이상의 정규형이 동일한 가중치로 기여하는 경우(예: 벤젠 또는 카르복실산 음이온에서) 정규형 중 하나가 임의로 선택되면, 골격 구조식은 비편재화된 결합이 비동등한 단일 및 이중 결합으로 묘사되더라도 분수 차수의 동등한 결합을 포함하는 실제 구조를 묘사하는 것으로 이해된다.
2. 3. 현대적 표기 규칙
ChemDraw 소프트웨어 패키지가 사실상의 업계 표준으로 채택되면서 1980년대에 정립된 현대 골격 구조식의 그래픽 규칙은 1990년대 후반부터 화학 문헌에서 거의 보편화되었다.[3] 대부분의 저자가 따르는 규칙은 다음과 같다.
2. 4. 원자 및 치환기 표기
탄소나 수소가 아닌 모든 원자는 화학 기호로 표시된다. 예를 들어 염소는 Cl, 산소는 O, 나트륨은 Na 등으로 표시된다. 유기 화학의 맥락에서 이러한 원자는 일반적으로 '''헤테로원자'''라고 한다. (접두사 ''헤테로-''는 그리스어 ''ἕτερος'' héteros에서 유래되었으며 "다른"을 의미한다.)[4]헤테로원자에 결합된 모든 수소 원자는 ''명시적으로'' 그려진다. 예를 들어 에탄올(C2H5OH)에서 산소에 결합된 수소 원자는 H 기호로 표시되지만, 탄소 원자에 결합된 수소 원자는 직접적으로 표시되지 않는다. 헤테로원자-수소 결합을 나타내는 선은 명확성과 간결성을 위해 보통 생략되므로 하이드록실기와 같은 작용기는 −O−H 대신 −OH로 가장 자주 표기된다. 이러한 결합은 반응 메커니즘에 참여할 때 그 존재를 강조하기 위해 때때로 전체적으로 그려진다.
골격 구조식에서는 화학 기호처럼 보이지만, 특정 매우 흔한 치환체를 나타내거나 원소 그룹의 지정되지 않은 구성원을 나타내는 기호도 있다. 이를 의사 원소 기호 또는 유기 원소라고 하며, 골격 구조식에서 1가 "원소"처럼 취급된다.[4]
일반적인 의사 원소 기호, 유기 원소 기호, 방향족 및 불포화 치환기, 작용기, 설포닐/설폰산염 그룹, 보호기는 다음과 같다.
2. 5. 다중 결합 표현
두 개의 원자는 여러 쌍의 전자를 공유하여 결합될 수 있다. 탄소의 일반적인 결합은 단일 결합, 이중 결합 및 삼중 결합이다. 단일 결합이 가장 일반적이며, 골격 구조식에서 두 원자 사이에 단일 실선으로 표시된다. 이중 결합은 두 개의 평행선으로 표시되고, 삼중 결합은 세 개의 평행선으로 표시된다.더 진보된 결합 이론에서는 결합 차수가 정수가 아닌 값을 갖는 경우도 존재한다. 이러한 경우, 실선과 점선의 조합은 각각 결합 차수의 정수 부분과 비정수 부분을 나타낸다.
2. 6. 방향족 고리 표현
방향족 벤젠 고리는 두 가지 방식으로 표현할 수 있다.
- 케쿨레 스타일: 1872년 케쿨레가 처음 제안한 방식으로, 단일 결합과 이중 결합이 번갈아 나타나는 육각형으로 묘사한다. 벤젠의 두 가지 정준 형태는 모든 탄소-탄소 결합 길이가 같고 결합 차수가 1.5임을 나타낸다.
- 틸레 스타일: 요하네스 틸레가 제안한 방식으로, 비편재화된 파이 오비탈을 단일 결합 육각형 내부에 원을 그려 표현한다. 과거 유기 화학 입문 교과서에서 흔히 사용되었으며, 비공식적인 상황에서 종종 사용된다.
최근에는 전자의 움직임을 정확하게 표현하고 전자쌍을 추적할 수 있는 케쿨레 스타일이 교육 및 학술적 맥락에서 주로 사용된다.
3. 입체화학 표현
입체화학은 골격 구조식에서 편리하게 표시된다.[5]
골격 구조식에서 입체화학을 나타내는 주요 방법은 다음과 같다.
- 실선: 종이나 화면 평면에 있는 공유 결합을 나타낸다.
- 굵은 쐐기: 관찰자를 향해 종이나 화면 평면 밖으로 튀어나오는 결합을 나타낸다.
- 해시된 쐐기 또는 파선 (굵거나 얇음): 관찰자로부터 멀어져 종이나 화면 평면 안쪽으로 들어가는 결합을 나타낸다.
- 물결선: 알 수 없는 입체화학 또는 해당 지점에서 가능한 두 입체 이성질체의 혼합물을 나타낸다.



3. 1. 결합 표현
입체화학은 골격 구조식에서 편리하게 표시된다.[5]화학 결합은 여러 가지 방법으로 묘사할 수 있다.
- 실선은 종이나 화면 평면에 있는 공유 결합을 나타낸다.
- 굵은 쐐기는 관찰자를 향해 종이나 화면 평면 밖으로 튀어나오는 결합을 나타낸다.
- 해시된 쐐기 또는 파선(굵거나 얇음)은 관찰자로부터 멀어져 종이나 화면 평면 안쪽으로 들어가는 결합을 나타낸다.
- 물결선은 알 수 없는 입체화학 또는 해당 지점에서 가능한 두 입체 이성질체의 혼합물을 나타낸다.
- 과거 스테로이드 화학에서 흔히 사용되던 수소 입체화학 묘사법으로, 꼭짓점에 중심이 있는 채워진 원(H-점/H-대시/H-원)은 위로 향하는 수소 원자를, 꼭짓점 옆의 두 개의 해시 마크 또는 비어 있는 원은 아래로 향하는 수소 원자를 나타낸다. (IUPAC는 현재 이 표기법을 권장하지 않는다.)
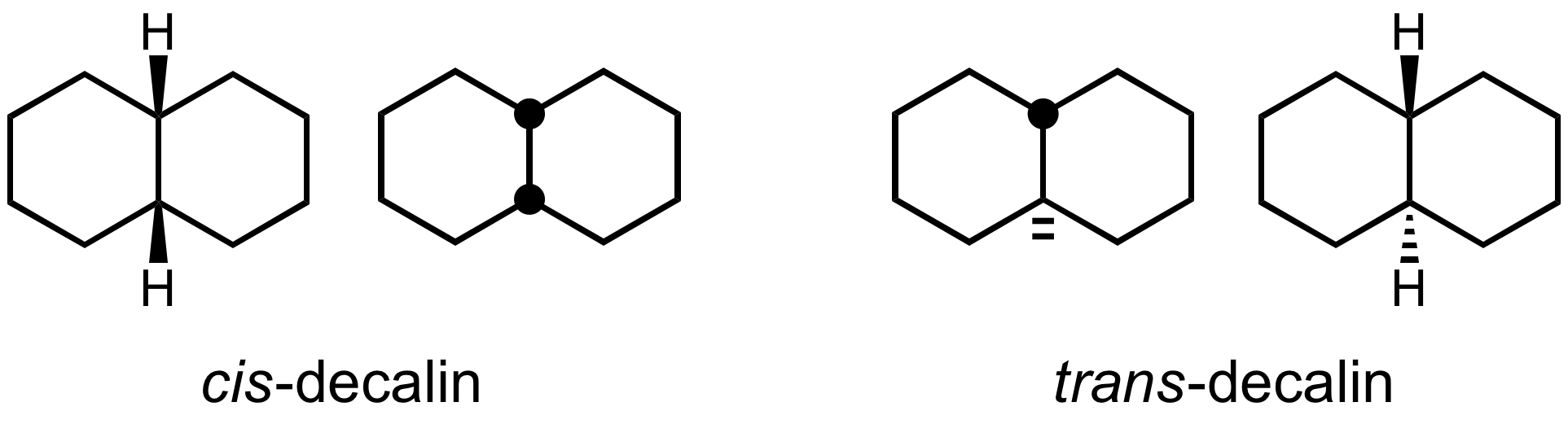
이 표기법은 1932년 리하르트 쿠ーン의 출판물에서 실선과 점선을 사용하면서 시작되었다. 현대적인 실선과 해시 쐐기는 1940년대 줄리오 나타가 고중합체의 구조를 나타내기 위해 도입했고, 1959년 도널드 J. 크램과 조지 S. 해먼드의 교과서 ''유기 화학''에서 널리 대중화되었다.[6]
골격 구조식은 알켄의 ''시스'' 및 ''트랜스'' 이성질체를 나타낼 수 있다. 물결 모양의 단일 결합은 알 수 없거나 지정되지 않은 입체화학 또는 (사면체 입체 중심과 같이) 이성질체의 혼합물을 나타내는 표준 방법이다. 교차된 이중 결합이 때때로 사용되었지만, 더 이상 일반적인 용도로 허용되는 스타일로 간주되지 않는다. 다만, 컴퓨터 소프트웨어에서는 필요할 수 있다.[5]

3. 2. 수소 결합 표현

수소 결합은 일반적으로 점선 또는 파선으로 표시된다. 다른 맥락에서 파선은 전이 상태에서 부분적으로 형성되거나 끊어진 결합을 나타낼 수도 있다.
참조
[1]
서적
General, Organic, and Biological Chemistry
Cengage
[2]
웹사이트
Replacement of Skeletal Atoms
http://www.chem.qmul[...]
IUPAC Recommendations
1999
[3]
학술지
Graphical representation standards for chemical structure diagrams (IUPAC Recommendations 2008)
2008
[4]
서적
Clayden
[5]
학술지
Graphical representation of stereochemical configuration (IUPAC Recommendations 2006)
http://www.iupac.org[...]
[6]
학술지
The Historical Origins of Stereochemical Line and Wedge Symbolism
[7]
서적
General, Organic, and Biological Chemistry
Cengage
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com